ALDEHÍDOS
Introducción
En síntesis los aldehídos son un compuesto orgánico que puede encontrarse tanto en fuentes naturales como en laboratorio, estos gracias a su grupo funcional adquirió propiedades físicas y químicas que le diferencian.
- CH2 - CHO Pentanodial
ALDEHÍDOS Y SUS PROPIEDADES
Los Aldehídos por la presencia del grupo carbonilo adquiere ciertas características,tanto físicas como químicas, que le diferencian de los demás compuestos orgánicos.
Propiedades Físicas:
Los primeros aldehidos de la clase presentan un olor picante y penetrante, facilmente distinguible por los seres humanos.
El punto de ebullición de los aldehidos es en general, mas alto que el de los hidrocarburos de peso molecular comparable.
La solubilidad en agua de los aldehidos depende de la longitud de la cadena , hasta 5 átomos de carbono tienen una solubilidad significativa como sucede en los alcoholes, ácidos carboxilicos y eteres. Apartir de 5 atomos la insolubilidad tipica de la cadena de hidrocarburos que forma parte de la estructura a ser dominante la solubilidad cae bruscamente.
El metanal es gaseoso, los demás son líquidos hasta el pentadecanal y después sólidos, son incoloros, de olor agradable: los 5 primeros son muy solubles en agua.
Son combustibles en su mayoría, y como son fácilmente oxidables se convierten en ácidos orgánicos.
Propiedades Químicas:
El grupo carbonilo de los aldehídos es fuertemente reactivo y participa en una amplia variedad de importantes transformaciones , sus reacciones mas importantes serian:
Reducción a alcoholes:
Por contacto con hidrógenos en presencia de ciertos catalizadores el doble enlace carbono=oxigeno del grupo carbonilo se rompe y un átomo de hidrógeno se acopla a uno de los enlaces para formar el grupo hidroxilo típico de los alcoholes.
Reducción a hidrocarburos:
Los aldehídos pueden ser reducidos a hidrocarburos al interactuar con cierto reactivos y en presencia de
catalizadores ;En la reducción Wolff-Kishner el acetaldehído se trata con hidracina como agente reductor y
etoxido de sodio como catalizador. El resultado de la reacción produce una mezcla etano, agua nitrógeno.
Polimerización:
Los primeros aldehídos dela clase tienen una marcada tendencia a polimerizar.
El formaldehido por ejemplo, polimeriza de forma espontanea a temperatura ligeramente superior a la de congelación (-92ºC).Del mismo, cuando se evapora una solución al 37% de formaldehido en agua que contenga 10 a 15% de metanol se produce un polímero solido que se conoce como parafolmaldehido, si se calienta este se vuelve a ser formaldehido en forma gaseosa.
Reacciones de adición:
Los aldehídos también sufren reacciones de adición, en las se rompe la estructura molecular del aldehído y el agente reaccionante se agrega a la molécula para formación de un nuevo compuesto.
USOS
Los usos de los aldehídos se presentan desde la creación de perfumes hasta de plásticos, pinturas, esencias y solventes.
Los dos efectos más importantes de los aldehidos son: narcotizantes e irritantes.
El glutaraldehido se usa como: desinfectante en frío (Instrunet®) y el curtido de pieles. Es causante de dermatitis alérgicas.
El formaldehido se usa en:
a) Fabricación de plásticos y resinas.
b) Industria fotográfica, explosivos y colorantes
c) Como antiséptico y preservador.
Los principales efectos del formaldehido son: irritación de las vías respiratorias y ojos y dermatitis (las resinas). El NIOSH lo ha propuesto como potencialmente cancerígeno (ca. nasal en ratas).
En los RPA para puestos de trabajo con exposición a formaldehido, se descartarán: personas con alteraciones respiratorias y cutáneas.
El furfural se usa como:
a) Fabricación de plásticos
b) Como herbicida, fungicida y pesticida.
c) Acelerador en la vulcanización.

Formula Vainilla.
RIESGOS PARA LA SALUD
La mayor parte de los aldehídos pueden causar irritación de
la piel, los ojos y el sistema respiratorio, siendo este efecto más pronunciado
en los miembros inferiores de una serie, en los miembros con la cadena
alifática insaturada y en los miem- bros con sustitución halógena. Los
aldehídos pueden tener un efecto anestésico, pero las propiedades irritantes de
algunos de ellos posiblemente obligen al trabajador a limitar la exposición
antes de que ésta sea suficiente como para que se manifiesten los efectos
anestésicos. El efecto irritante en las mucosas puede estar relacionado con el
efecto cilioestático que inhibe el movimiento de los cilios que tapizan el
tracto respiratorio con funciones esencialmente de limpieza. El grado de
toxicidad varía mucho en esta familia. Algunos aldehídos aromáticos y ciertos
aldehídos alifáticos se metabolizan rápidamente y no producen efectos adversos,
pudiendo utilizarse sin riesgos como aromas alimentarios. No obstante, otros
miembros de la familia son cancerígenos conocidos o sospechosos y exigen la
adopción de medidas de precaución siempre que exista posibilidad de contacto con
ellos. Algunos son mutágenos químicos y otros, alergenos. También tienen la
capacidad de producir un efecto hipnótico. En el texto siguiente y en las
tablas adjuntas se facilitan más datos sobre miembros específicos de la
familia.
En la salud
Se tienen aldehídos y cetonas de manera natural en el cuerpo, en el metabolismo fermentativo de la glucosa , da como una reacción un grupo Aldehído (CHO) en la parte final. También están presentes en la oxidación de los alcoholes y por lo tanto cuando tomas bebidas alcoholicas la resaca que se produce en el cuerpo en gran medida es responsabilidad de los aldehídos.
Las cetonas por su parte particia en el ciclo de Krebs como dihidroxiacetona fosfato convirtiendo el glicerol en glucosa, se puede excretar de manera anormal en desnutrición, quemaduras, deshidratación, fiebre y ejercicio excesivo.
También l
os aldehídos son altamente tóxicos y muy irritantes a la piel al igual que algunas cetonas que son utilizadas como solventes, especialmente para derivados de celulosa, en lacas y pinturas
Nomenclatura.
Nomenclatura de los aldehídos
Se nombran añadiendo al nombre del hidrocarburo del que
derivan el sufijo -al.
Si hay dos grupos aldehído, uno en cada extremo, la terminación será -dial.
OHC - CH2- CH2- CH2 - CHO
Pentanodial
Si el grupo carbonilo se conecta al extremo de un alcano no
lineal, la nomenclatura es similar a la que se ha utilizado para los alcanos
ramificados.
Fórmulas del Metanal, Etanal, Propanal y Butanal
Para nombrar a los aldehídos se cambia la terminación o de los alcanos por al para denotar la presencia de un aldehído
.El grupo carbonilo de los alcanales o aldehidos siempre está al final de la cadena.
Este hecho lo hace química y físicamente diferente a las cetonas, por eso se considera como un grupo funcional aparte
El hidrógeno vecino al oxígeno es fácilmente oxidable y esta es una de las principales diferencias entre estas dos familias de compuestos
Como este grupo funcional siempre está al final de la cadena no se usan números localizadores.
 pentanal, NO 1-pentanal.
pentanal, NO 1-pentanal.
Sin embargo si por alguna razón se usa el prefijo oxo en este caso si hay que unir número localizador ya que este prefijo puede estar en cualquier lugar de la cadena pues se usa tambien con las cetonas
Los aldehídos más simples (metanal y etanal) tienen otros nombres que no siguen el estándar de la IUPAC pero son más utilizados (formaldehído y acetaldehído, respectivamente) estos últimos dos son nombrados en nomenclatura trivial.
También se utiliza el prefijo formil- cuando hay tres o más funciones aldehídos sobre el mismo compuesto. En esos casos se puede utilizar otro sistema de nomenclatura que consiste en dar el nombre decarbaldehído a los grupos CHO (los carbonos de esos CHO no se numeran, se considera que no forman parte de la cadena). Este último sistema es el idóneo para compuestos con grupos CHO unidos directamente a ciclos.
Grupo Carbonilo
Los grupos Carbonilo tienen un átomo de oxígeno con doble ligadura a un átomo de carbono (simbolizado como C=O). Como los grupos hidroxilo, los grupos carbonilo contribuyen a hacer moléculas solubles en el agua. Todas las moléculas de azúcar tienen un grupo carbonilo, además de grupos hidroxilo en los otros átomos de carbono.
Este grupo esta presente en los aldehídos y así también en las cetonas

 Grupo aldehído, donde el grupo C=O está al final de una molécula orgánica. Un átomo de hidrógeno se ubica también sobre el mismo átomo de carbono.
Grupo aldehído, donde el grupo C=O está al final de una molécula orgánica. Un átomo de hidrógeno se ubica también sobre el mismo átomo de carbono.
Los grupos funcionales le dan ciertas características especiales al molécula en el caso de el grupo carbonilo:
Los compuestos carbonílicos presentan puntos de ebullición más bajos que los alcoholes de su mismo peso molecular. No hay grandes diferencias entre los puntos de ebullición de aldehídos y cetonas de igual peso molecular.
Los compuestos carbonílicos de cadena corta son solubles en agua y a medida que aumenta la longitud de la cadena disminuye la solubilidad.
Reacciones
La reacciones de los aldehídos y cetonas son esencialmente de tres tipos; adición nucleofílica, oxidación y reducción.
Adición nucleofílica
Debido a la resonancia del grupo carbonilo
La reacción más importante de aldehídos y cetonas es la reacción
de adición nucleofílica cuyo mecanismo es el siguiente:
Siguen este esquema la reacción con hidruros ( NaBH4, LiAlH4 ) donde Nu- = H- y la reacción con organometálicos (RMgLi, RLi) donde Nu- = R-.
BIBLIOGRAFIA
http://www.ecured.cu/index.php/Aldeh%C3%ADdos
http://www.rubber-accelerator.com/resources/images/product/TBBS.JPG
http://www.vidamasverde.com/blog/wp-content/uploads/2013/05/id8337.jpg
http://www.occiplast.com/images/100.jpg
http://aldehidosycetona.blogspot.com/2010/08/riesgos-para-la-salud-aldehidos-y.html
http://www.youtube.com/watch?v=ulKUREc_yHo
http://aldehidosquimicaorganica.blogspot.com/


.jpg)







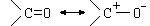


































.jpg)
